Resumos
A inflamação, localizada ou sistêmica, é uma das características de doenças reumatológicas. A resposta a uma lesão tecidual desencadeia uma série de modificações que promovem eliminação de patógenos, limitação do dano tecidual e restauração da estrutura lesada. Essas modificações dependem do aumento ou da diminuição da concentração sérica de proteínas, conhecidas como biomarcadores inflamatórios, que atuam na resposta inflamatória. A análise laboratorial desses marcadores permite, juntamente com os dados clínicos e outros exames complementares, acessar a atividade de algumas doenças e monitorar a resposta à terapêutica, assim como pode sugerir presença de infecção. Atualmente, o reumatologista tem à sua disposição algumas opções de exames que avaliam a resposta inflamatória, como a proteína C-reativa, a velocidade de hemossedimentação e a eletroforese de proteínas, entre outros. Este artigo revisa as características de alguns desses biomarcadores e o emprego das provas de atividade inflamatória em doenças reumatológicas.
proteínas de fase aguda; proteína C-reativa; velocidade de hemossedimentação; doenças reumatológicas; resposta inflamatória
Inflammation is the hallmark of rheumatic diseases. Tissue injury response promotes several modifications, which result in elimination of the offending agent, limitation of tissue damage, and restoration of affected structures. Such modifications depend on the increase or decrease of the serum concentration of certain proteins known as inflammatory biomarkers. Laboratory analysis of these markers assists in monitoring disease activity and treatment response. Rheumatologists have available methods that evaluate inflammatory reaction such as C-reactive protein, erythrocyte sedimentation rate, and protein electrophoresis, among others. In this paper, we review some of those biomarkers and their use in rheumatic diseases.
acute-phase proteins; C-reactive protein; erythrocyte sedimentation rate; rheumatic diseases; inflammatory response
ARTIGO DE REVISÃO
O uso de provas de atividade inflamatória em reumatologia
Nilton Salles Rosa NetoI; Jozélio Freire de CarvalhoII
IMédico residente do Serviço de Reumatologia do Hospital das Clínicas (FMUSP)
IIProfessor colaborador da disciplina de Reumatologia da Faculdade de Medicina (USP) e Médico Assistente Doutor do Serviço de Reumatologia do Hospital das Clínicas (FMUSP)
Endereço para correspondência Endereço para correspondência: Dr. Jozélio Freire de Carvalho Disciplina de Reumatologia Av. Dr. Arnaldo, 455, 3º andar, sala 3190 Cerqueira César, São Paulo, SP Tel./Fax: (11) 3061-7490 E-mail: jotafc@gmail.com
RESUMO
A inflamação, localizada ou sistêmica, é uma das características de doenças reumatológicas. A resposta a uma lesão tecidual desencadeia uma série de modificações que promovem eliminação de patógenos, limitação do dano tecidual e restauração da estrutura lesada. Essas modificações dependem do aumento ou da diminuição da concentração sérica de proteínas, conhecidas como biomarcadores inflamatórios, que atuam na resposta inflamatória. A análise laboratorial desses marcadores permite, juntamente com os dados clínicos e outros exames complementares, acessar a atividade de algumas doenças e monitorar a resposta à terapêutica, assim como pode sugerir presença de infecção. Atualmente, o reumatologista tem à sua disposição algumas opções de exames que avaliam a resposta inflamatória, como a proteína C-reativa, a velocidade de hemossedimentação e a eletroforese de proteínas, entre outros. Este artigo revisa as características de alguns desses biomarcadores e o emprego das provas de atividade inflamatória em doenças reumatológicas.
Palavras-chave: proteínas de fase aguda, proteína C-reativa, velocidade de hemossedimentação, doenças reumatológicas, resposta inflamatória.
INTRODUÇÃO
A resposta de fase aguda é um mecanismo fisiopatológico de defesa associado a estados inflamatórios que, apesar do nome já consagrado, ocorre tanto na inflamação aguda quanto na crônica. Caracteriza-se pelo aumento ou diminuição da concentração sérica de determinadas proteínas em decorrência de algum estímulo que ocasione injúria tecidual.1-3 Atualmente, opta-se por utilizar o termo biomarcador inflamatório ao se referir às proteínas envolvidas nessa resposta.
Utiliza-se a análise dos biomarcadores de inflamação em doenças reumatológicas para a monitoração de atividade de doença - correlacionando com outros dados clínicos e laboratoriais - e para a diferenciação entre doença ativa e presença de infecções.
Este artigo revisa o uso de provas de atividade inflamatória atualmente disponíveis no âmbito assistencial.
HISTÓRICO
Em 1930, pesquisadores descobriram uma proteína que reagia com o polissacarídeo C da cápsula de S. pneumoniae obtida do sangue de pacientes durante a fase aguda de pneumonia pneumocócica. A ela, deram o nome de proteína C-reativa (PCR). A partir de então, estudaram-se as alterações das proteínas plasmáticas em soro de pacientes agudamente enfermos devido a infecções. As proteínas encontradas nessas situações foram denominadas proteínas de fase aguda, e a reação inflamatória - ou resposta do organismo frente à lesão tecidual -, resposta de fase aguda.4
Posteriormente, verificou-se a presença dessas proteínas após outros eventos, tais como trauma, isquemia, neoplasia e reações de hipersensibilidade. Suas concentrações também se encontravam alteradas em estados inflamatórios crônicos.1,2
RESPOSTA DE FASE AGUDA
A resposta de fase aguda caracteriza-se pela alteração na concentração sérica de certas proteínas após a injúria tecidual, algumas respondendo com elevação (biomarcadores positivos) e outras com diminuição (biomarcadores negativos) de suas concentrações. Essas proteínas terão funções pró e anti-inflamatórias e podem estimular ou inibir a produção umas das outras. Apesar da importância desse trabalho em conjunto, na prática clínica somente algumas dessas proteínas são utilizadas como marcadores, quer pela disponibilidade do método, quer pelo custo de sua determinação. Podem ser encontradas nas Tabelas 1 e 2 algumas das proteínas de fase aguda, divididas de acordo com sua função biológica original.
Mudanças comportamentais e alterações fisiológicas, bioquímicas e nutricionais somam-se para completar a resposta de fase aguda.2,3
Alterações neuroendócrinas
Uma das maiores características desta fase é a presença de febre, uma resposta existente para promover um meio ótimo de funcionamento de enzimas e a estabilização de membranas celulares. Há indisposição e sonolência - medidas que reduzem o consumo energético do organismo.
Modulando a resposta inflamatória, há aumento da secreção de hormônio liberador de corticotrofinas (CRH), hormônio adrenocorticotrófico (ACTH) e cortisol, hormônio antidiurético (ADH) e catecolaminas; e diminuição do fator de crescimento similar à insulina do tipo 1 (IGF-1).
Alterações hematopoéticas
Em decorrência de inflamação, podemos encontrar leucocitose e trombocitose e, nos casos mais prolongados, anemia de doença crônica.
Alterações metabólicas
Incluem-se perda muscular e balanço nitrogenado negativo, levando, em casos crônicos, à restrição de crescimento em crianças e à caquexia em adultos. Há diminuição da gliconeogênese e aceleração de osteoporose. Verificam-se aumento da lipogênese hepática e lipólise de tecido adiposo, assim como diminuição da atividade das lipoproteínas lipases muscular e adiposa, com o objetivo de, em casos de infecção, haver aumento da concentração de lipoproteínas, promovendo maior ligação à lipopolissacáride (LPS) e resultando em menor efeito tóxico para o organismo.
Alterações hepáticas
O fígado participa da produção e da liberação de muitas das proteínas relacionadas à resposta inflamatória. Fisiologicamente, há aumento de metalotioneína, óxido nítrico sintase, heme oxigenase, superóxido dismutase, inibidor tecidual de metaloproteinase-1 e redução da atividade fosfoenolpiruvato carboxiquinase.
Alterações em outros constituintes do plasma
Como controle das reações em andamento, há consumo de zinco, ferro e cobre e retinol plasmático e aumento de antioxidantes como glutationa.
CLASSIFICAÇÃO
Os biomarcadores da inflamação dividem-se em quatro grupos:1
Proteínas de defesa do hospedeiro - participam do reconhecimento e eliminação de patógenos: proteína C-reativa, lectina ligadora de manose, proteína ligadora de lipopolissacarídeo, proteínas do complemento, fibrinogênio;
Inibidores de proteinases séricas - atuam na limitação do dano tecidual, neutralizando enzimas proteolíticas e metabólitos de oxigênio: α1-antiproteinase, α1-antiquimiotripsina, α2-antiplasmina, inibidor do C1;
Proteínas de transporte com atividade antioxidante - responsáveis pela contenção da reação inflamatória e restauração da estrutura original lesada: ceruloplasmina, hemopexina, haptoglobina;
Outras - proteína sérica amiloide A (SAA), antagonista do receptor de IL-1, α1-glicoproteína ácida, fosfolipase A2 secretória grupo IIA (sPLA2-IIA).
Há diferenças significativas em termos de cinética, magnitude e duração de resposta entre os biomarcadores inflamatórios. A PCR e a SAA são detectadas a partir de quatro horas do insulto e têm pico de 24 a 72 horas, podendo chegar a mil vezes o valor normal.3 O fibrinogênio tem pico em sete a dez dias e eleva-se duas a três vezes o normal (Figura 1).
Apenas alguns desses marcadores encontram-se disponíveis para utilização na rotina do reumatologista, e o texto trata, inicialmente, das origens e funções biológicas das proteínas envolvidas e dos métodos de determinação de sua atividade. Em seguida, detalhamos seus usos nas diversas doenças reumáticas.
PROTEÍNA C-REATIVA
É o biomarcador mais estudado. Promove a interação entre imunidades humoral e celular. É produzida no fígado e classificada como pentraxina - um pentâmero com uma fenda ligadora de fosfatidilcolina (dependente de íons cálcio) e outras em face oposta que se ligam ao componente do sistema complemento C1q e à porção Fc de imunoglobulinas (Fcγ).1,3
Sua função é ligar-se a patógenos e células lesadas e/ou apoptóticas (fosfatidilcolina) e iniciar sua eliminação por meio da ativação do sistema complemento e de fagócitos (C1q e Fcγ). Essas ligações e atrações celulares permitem considerá-la como uma opsonina.5,6 Também atua regulando a extensão e a intensidade da reação inflamatória.
Apesar de sua função assemelhar-se à de anticorpos e participar da imunidade inata, não há descrição de estados deficientes de proteína C-reativa (PCR), o que, a princípio, deve ser incompatível com a vida.
A ativação do complemento ocorre pela via clássica, por deposição dos fragmentos de C3 e C4 na PCR e no ligante, formação da C3 convertase clivando o C3 em C3a, uma anafilatoxina que induz a liberação de histamina de basófilos e mastócitos, e C3b, que atua como opsonina, atraindo fagócitos - macrófagos - ao local da inflamação. A ativação não converte C5, ou seja, não há amplificação dos efeitos pró-inflamatórios ou formação do complexo de ataque à membrana (CAM) diretamente pela PCR. A PCR e a via clássica do complemento atuam em sintonia, promovendo a limpeza de células apoptóticas sem ocasionar lise celular, minimizando a liberação de mediadores que aumentariam a reação inflamatória.5 É sabido que, na artrite reumatoide (AR), o complemento é ativado pela PCR, especialmente naqueles com maior atividade de doença, porém não está clara a participação da ativação do complemento na manutenção da reação inflamatória e destruição articular.7
A interação entre PCR e porção Fc de imunoglobulinas dá-se, em fagócitos, por meio de receptores FcγRI (CD64) e FcγRIIa (CD32), levando à indução de fagocitose e à secreção de citocinas pró-inflamatórias como interleucina (IL)-1 e fator de necrose tumoral (TNF)-α. Já em neutrófilos, a interação promove down-regulation da inflamação com inibição da resposta quimiotática, clivagem de L-selectina diminuindo a marginação de leucócitos e endocitose de receptores IL-6.4,8
Verifica-se, portanto, que a PCR tem funções pró e anti-inflamatórias.
A determinação da PCR é mais sensível, avaliando uma resposta rápida por uma medida direta. Reflete, também, a extensão do processo inflamatório ou da atividade clínica, principalmente em infecções bacterianas (e não virais), reações de hipersensibilidade, isquemia e necrose tecidual. Podem-se encontrar valores discretamente elevados de PCR em obesidade, tabagismo, diabetes, uremia, hipertensão arterial, inatividade física, uso de anticoncepcionais orais, distúrbios do sono, álcool, fadiga crônica, depressão, envelhecimento, doença periodontal, entre outras situações. É também um marcador de aterosclerose, sendo um preditor de infarto do miocárdio, morte súbita ou acidente vascular encefálico e deve ter papel na patogênese da aterogênese.4,8-10
A metodologia amplamente utilizada é a imunonefelometria, que permite a liberação de resultados quantitativos, facilitando a interpretação clínica e permitindo o acompanhamento laboratorial de cada caso.
A PCR também é importante como marcador de ativação endotelial e indutor de lesão vascular relacionada à inflamação, em especial em placas de ateroma. Pode ser utilizada como preditor de coronariopatias (angina e infarto do miocárdio), por acelerar o processo de aterosclerose. A denominação de PCR hipersensível, ou ultrassensível, diz respeito a métodos que possam detectar valores mais baixos (menor do que o percentil 97,5) do que os limites dos métodos usuais (menor do que percentil 90), ou seja, exames mais sensíveis, que já identifiquem alterações inflamatórias em pacientes aparentemente saudáveis ou com fatores de risco conhecidos e permitam estimar o risco cardiovascular.11 Em pacientes com AR e lúpus eritematoso sistêmico (LES), a inflamação persistente, demonstrada por dosagens sequenciais de PCR, implica morbidade e mortalidade cardiovascular precoce.12
FIBRINOGÊNIO
O fibrinogênio é uma proteína abundante no plasma que desempenha papel fundamental na hemostasia. Nas reações inflamatórias, tem provável papel no reparo tecidual e na cicatrização.
Sua molécula é composta por duas subunidades ligadas por uma ponte dissulfato. A clivagem por trombina resulta em dois fibrinopeptídeos, e a molécula resultante polimeriza-se e mantém-se estável devido ao fator XIII e a pontes interplaquetárias (ligação do fibrinogênio a glicoproteínas IIb/IIIa) formando a fibrina.
Por meio de receptores semelhantes aos das glicoproteínas IIb/IIIa, interage com o endotélio e interfere na adesão, motilidade e organização do citoesqueleto. Uma vez formada a fibrina, estimula a adesão, a dispersão e a proliferação de células endoteliais.1
Velocidade de hemossedimentação
A velocidade de hemossedimentação (VHS) reflete o aumento da concentração plasmática de proteínas de fase aguda, principalmente a de fibrinogênio. Avalia, portanto, uma resposta lenta por medida indireta. A sedimentação depende da agregação das hemácias. Devido a suas cargas negativas, elas tendem a se repelir, porém a presença de outras moléculas carregadas positivamente pode neutralizar a repulsão e permitir a formação do rouleaux - agregação eritrocitária em torno do mesmo eixo -, que, por ser mais pesado, tende a se depositar no fundo. Quanto maior a presença de macromoléculas, maiores a agregação e o depósito de hemácias, e maior a distância entre o agregado e o topo da coluna, o que significa maior valor de VHS, dentro da hora de análise. Dentre as proteínas plasmáticas, a que tem maior efeito agregante é o fibrinogênio, seguido das globulinas e da albumina.13
Há diversos fatores que podem interferir na interpretação do valor da VHS. Dentre os interferentes analíticos, há o erro de diluição, a inclinação do tubo, a demora em realizar o exame após a coleta e a temperatura ambiente. Pode haver influência do uso de medicamentos como anticoncepcionais orais e anticoagulantes. Há também diferenças fisiológicas, como menor VHS no sexo feminino e maior em idosos e gestantes.
Estados patológicos não inflamatórios podem alterar a VHS, como baixo hematócrito, macrocitose e hipercolesterolemia, que tendem a aumentar a velocidade, e hipofibrinogenemia, hipogamaglobulinemia, policitemia, microcitose, anemias hemolíticas e hemoglobinopatias, que tendem a diminuí-la.13
Recomenda-se, pelo International Committee for Standardization in Hematology (ICSH), a técnica de Westergren para análise da VHS.
PROTEÍNA SÉRICA AMILOIDE A
A SAA é também uma pentraxina como a PCR e tem três isoformas, porém somente duas delas são proteínas de fase aguda (SAA aguda) e a outra é constitutiva.14 O maior local de produção é o fígado.
Participa do transporte e do metabolismo do colesterol, ligando-se predominantemente à lipoproteína de alta densidade (HDL)-3. Durante a inflamação, ocupa o lugar da apolipoproteína A-1, e essa ligação pode ser pró-aterogênica.14 Tem função de defesa, atuando na quimiotaxia de neutrófilos, monócitos e linfócitos T; catalisa atividade da fosfolipase A2 secretória, que facilita ação da PCR; e tem função reparadora tecidual, induzindo a formação de metaloproteinases de matriz 2 e 3, colagenase e estromelisina. Como a PCR, também atua na opsonização de células apoptóticas, ligando-se especificamente à fosfatidiletanolamina, ativando a via clássica do complemento. Os ligantes das pentraxinas incluem lipídeos e polissacarídeos microbianos, componentes de matriz e antígenos nucleares expostos durante morte celular. Para que ocorra a fagocitose, é necessário haver interação com FcγR.6
As principais citocinas envolvidas na indução da SAA aguda são a IL-1, o TNF-α e a IL-6.
É o marcador mais sensível da inflamação aguda e correlaciona-se bem com atividade clínica em AR. A estimulação crônica de sua produção pode desempenhar papel relevante na progressão da AR, principalmente pela indução de enzimas que degradam a matriz extracelular.14 O controle da resposta de fase aguda e a resolução da inflamação, não só no que tange à função da SAA, requerem inibição de fatores de transcrição e transdução, formação de antagonistas ou falsos receptores, liberação de citocinas anti-inflamatórias e de glicocorticoides pelo organismo, para que se mantenha a homeostase.15
Já na inflamação crônica, a produção aumentada de SAA associada à menor degradação gera depósito tecidual e pode evoluir para amiloidose sistêmica do subtipo AA.1,16
A metodologia utilizada para aferir a proteína SAA é a imunonefelometria.
A1-GLICOPROTEÍNA ÁCIDA
A α1-glicoproteína ácida (AGP) é composta por alta porcentagem de carboidratos e resíduos de ácido siálico, apresentando grande carga negativa e solubilidade em água. É sintetizada pelo fígado, granulócitos e monócitos. Durante a fase aguda inflamatória, ela sofre mudança do padrão de glicosilação, o que altera sua função biológica. Ela tem atividade tanto pró como anti-inflamatória. Dentre suas funções estão a inibição da resposta quimiotática e da produção de superóxidos por neutrófilos, a inibição da agregação plaquetária e a indução da liberação de citocinas de monócitos (IL-1β, IL-6, IL-12, TNF-α, IL-1Ra e receptor de TNF-α solúvel).1,17,18
A metodologia utilizada para aferir a AGP é a imunonefelometria.
ELETROFORESE DE PROTEÍNAS
O plasma humano é composto de uma série de proteínas passíveis de identificação, e a eletroforese de proteínas é uma técnica simples para separá-las do soro. O exame consiste na colocação do soro em um meio especial e a aplicação de carga elétrica para que haja deslocamento das proteínas do polo positivo ao negativo de acordo com seus pesos moleculares e propriedades físicas. Separações mais específicas podem ser realizadas corando-se com agentes imunologicamente ativos que resultam em imunofluorescência e imunofixação. Em condições normais, encontram-se cinco bandas: albumina, alfa-1, alfa-2, beta (podendo se subdividir em beta-1 e beta-2) e gamaglobulinas.19
A banda da albumina é relativamente homogênea, porém as demais são compostas por uma mistura de diferentes proteínas.
Albumina
É a proteína mais abundante no plasma, aproximando-se de 60% da concentração total de proteínas. Ela é sintetizada exclusivamente pelo fígado. Suas funções compreendem transporte de diferentes substâncias e manutenção da pressão oncótica plasmática. Encontra-se com níveis diminuídos em doenças hepáticas, desnutrição, síndrome nefrótica, infecções crônicas, terapia hormonal, gravidez e queimaduras. Pode estar aumentada em pacientes desidratados.
Doenças inflamatórias - agudas e crônicas - são as maiores causas de queda da concentração plasmática de albumina. Dentre os fatores que predispõem à queda, estão hemodiluição, aumento da permeabilidade vascular levando à perda extravascular, aumento do consumo celular local e menor síntese, decorrente de inibição por citocinas.
α1-globulinas
A α1-antitripsina (α1-antiproteinase-1) representa cerca de 90% das proteínas que correm nesta faixa. A deficiência da α1-antitripsina está associada ao enfisema pulmonar e à cirrose hepática e só é detectável pela eletroforese quando homozigótica. Nos 10% restantes, estão a AGP e a alfafetoproteína, entre outras.
Os níveis se elevam nas doenças inflamatórias agudas e crônicas, neoplasias, após traumas ou cirurgias e durante a gravidez. Nos hepatocarcinomas, a elevação pode acontecer pelo aumento da alfafetoproteína. Entretanto, doenças hepáticas podem provocar diminuição global desta faixa.
α2-globulinas
Compreende a haptoglobina, a α2-macroglobulina e a ceruloplasmina. Encontra-se aumentada em insuficiência adrenal, uso de corticoterapia, diabetes mellitus avançado e síndrome nefrótica; e diminuída em desnutrição, anemia megaloblástica, enteropatias perdedoras de proteína, doenças hepáticas graves e doença de Wilson.
β-globulinas
Tem dois picos - o beta-1, composto essencialmente por transferrina, e o beta-2, composto pelas β-lipoproteínas (por exemplo, lipoproteína de baixa densidade - LDL). C3 e outros componentes do complemento, β2-microglobulina e antitrombina III também são encontrados nesta banda. Há aumento dessas globulinas nas inflamações agudas, síndrome nefrótica, hipotireoidismo, anemia ferropriva, hipertensão maligna, icterícia obstrutiva, gravidez e alguns casos de diabetes mellitus. Encontra-se diminuída nos casos de desnutrição.
γ-globulinas
Composta por imunoglobulinas, predominantemente IgG. As imunoglobulinas A, D, E, M e a PCR encontram-se na área de junção beta-gama. A ausência ou a diminuição da banda gama indica imunodeficiência congênita ou adquirida. O aumento sugere elevação de gamaglobulinas associadas a doenças inflamatórias crônicas, imunes ou não, doenças hepáticas ou mesmo neoplasias, todas de caráter policlonal.
As gamopatias monoclonais produzem um padrão específico (Figura 2). As bandas monoclonais ocorrem devido à proliferação de um clone de plasmócito que secreta determinada imunoglobulina que, encontrada em grande quantidade no plasma, torna-se responsável pelo pico encontrado ao exame. Quantidades progressivamente menores das imunoglobulinas policlonais são produzidas à medida que se vão substituindo os plasmócitos normais pelos neoplásicos. O uso diagnóstico mais comum da eletroforese de proteínas é para o reconhecimento dessas paraproteínas, especialmente o componente M do mieloma múltiplo. Podem-se encontrar picos monoclonais também em macroglobulinemia de Waldenström, amiloidose primária, gamopatia de significado indeterminado, leucemia de células plasmáticas, plasmocitoma solitário e doença de cadeia pesada.
A metodologia utilizada é a eletroforese automatizada em gel de agarose. Hemólise e hiperlipemia podem atuar como interferentes. Em reumatologia, utiliza-se principalmente na avaliação de gamopatias policlonais. No diagnóstico diferencial, encontram-se infecções: virais (hepatites, HIV, mononucleose e varicela), bacterianas (osteomielite, endocardite e bacteremia), tuberculose; doenças reumáticas: LES, doença mista do tecido conjuntivo, arterite temporal, AR, sarcoidose; doenças hepáticas: cirrose, uso abusivo de etanol, hepatite autoimune; neoplasias malignas: ovário, pulmão, hepatocelular, renal e estômago; doenças hematológicas: linfoma, leucemia, talassemia, anemia falciforme; e outras doenças inflamatórias, como doença de Crohn e retocolite ulcerativa, fibrose cística, bronquiectasias, entre outras.19
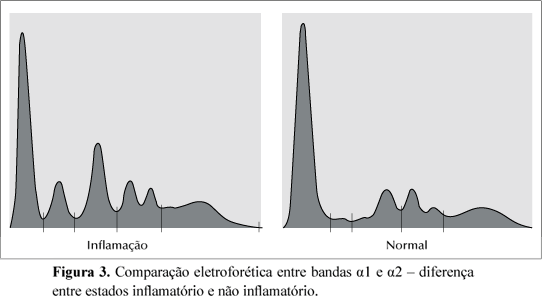
A Figura 3 mostra a comparação entre o resultado de um exame em paciente com estado inflamatório e em outro em condições normais.
Ferritina
É uma proteína encontrada em todas as células, especialmente nas envolvidas na síntese de compostos férricos e no metabolismo e reserva do ferro. Sua concentração aumenta em resposta a infecções, traumatismos e inflamações agudas. A elevação ocorre nas 24 a 48 horas iniciais, com um pico no terceiro dia, e se mantém por algumas semanas.20,21
As metodologias amplamente utilizadas são quimioluminescência e imunonefelometria. A presença de hemólise e hiperlipemia no soro constitui fator interferente.
Utilizada classicamente no acompanhamento da doença de Still, em que se correlaciona com atividade e remissão, a ferritina pode ser utilizada para a avaliação de síndrome de ativação macrofágica (hemofagocítica), na qual também podem ser encontrados valores maiores do que 10.000 μg/L.20 Atualmente, tem sido utilizada com preditor de parto prematuro, de gravidade de síndrome do estresse respiratório agudo, trauma craniencefálico e preditor de doenças cardiovasculares, assim como a PCR.
Pode achar-se elevada em casos de leucemias agudas e crônicas, neuroblastoma, melanoma maligno, tumores de linhagem germinativa, necrose hepática aguda e hemocromatose. Entretanto, nessas condições, raramente seus níveis se encontram acima de 3.000 μg/L.21-25
APLICAÇÃO CLÍNICA
Artrite reumatoide
Os níveis de PCR podem ser usados para estabelecer o diagnóstico - em especial, diferenciar de osteoartrite, na qual, porém, os níveis também estão acima dos da população normal.
Como explicado anteriormente, a VHS reflete a atividade de algumas semanas (elevação e declínio lentos) e é influenciada por diversos fatores, como idade, sexo e anemia, enquanto a PCR reflete mudanças de curto prazo e não sofre a mesma influência dos fatores citados, sendo mais sensível para mudanças na atividade de doença.26,27
Níveis elevados de PCR no início correspondem a um pior prognóstico e à doença erosiva progressiva. Há uma boa correlação da PCR com terapêutica e progressão radiológica, sendo melhor que o VHS.26 Entretanto, pode haver grande discordância entre resultados de VHS e PCR em até 28% dos pacientes, sendo os de pior estado clínico aqueles com PCR alta/VHS alta. Em seguida, situam-se aqueles com PCR alta/VHS baixa, PCR baixa/VHS alta e PCR baixa/VHS baixa, nessa ordem, quando se levam em conta avaliação de articulações acometidas, força, HAQ (Health Assessment Questionnaire), dor e gravidade global.28
Em alguns casos, como na AR precoce, a VHS pode ser melhor para o seguimento inicial do paciente, mas com a ressalva de que o exame deve ser analisado em até duas horas após a coleta, de preferência ainda no consultório médico,28 o que é incompatível com o cotidiano do reumatologista.
Não se pode esquecer que a doença progride independentemente da normalização dos valores de PCR. Antes do aparecimento de sintomas, altos níveis de PCR associam-se a maiores níveis de fator reumatoide ou antipeptídeo cíclico citrulinado (CCP). Porém, a presença do anti-CCP não se correlacionou estatisticamente a valores iniciais de VHS e PCR.1,29
Recentemente, demonstrou-se que níveis elevados da enzima metaloproteinase de matriz (MMP)-3 são melhores do que a PCR em prever doença erosiva progressiva em AR precoce, já que a (MMP)-3 é a mais específica da articulação e sofre menor influência sistêmica; mas a sensibilidade e a especificidade ainda não foram examinadas sistematicamente. Estudos transversais mostraram resultados conflitantes e o custo-benefício é ruim.30,31
Os escores e índices de atividade de doença incluem a VHS ou a PCR em seus cálculos, e estudos mostram que o DAS28 (disease activity index) com VHS é tão útil quanto o DAS28 com PCR no seguimento clínico.27 Estudos que compararam provas de fase aguda e o uso de ultrassonografia na avaliação evolutiva de AR mostraram que a VHS e a PCR tinham maior associação a medições do Power Doppler (que avalia vascularização e reflete inflamação) do que as avaliações por Modo-B (morfologia sinovial).32
É preciso lembrar que, além da PCR, a SAA pode ser utilizada no acompanhamento desses pacientes e, mais além, ambas desempenham importante papel na fisiopatologia da lesão articular.33
Artrite idiopática juvenil
Altos níveis de PCR associam-se a início poliarticular ou sistêmico, porém não pauciarticular. Há boa correlação com remissão de sintomas (exceção naqueles com amiloidose dentro de cinco anos do início).1
Doença de Still do adulto
Caracteriza-se pelo aumento da ferritina sérica, algumas vezes superior a 20.000 ng/mL. A ferritina eleva-se por lesão dos hepatócitos ou por ativação dos histiócitos e macrófagos. Há boa correlação com a atividade da doença, e níveis acima de 1.000 ng/mL são, na maioria dos estudos considerados, sugestivos da doença. Atualmente, o exame de maior sensibilidade para acompanhamento da doença é a ferritina glicosilada, que, em pessoas saudáveis, tem seus níveis entre 50 e 80% e, nos casos de doença de Still, seus níveis são, em geral, menores que 20%. Doenças inflamatórias em geral têm níveis que oscilam entre 20 e 50%. Entretanto, não fazem parte dos critérios para a definição da doença.20,22,34,35
Espondilite anquilosante e artrite psoriática
Nestas doenças, discute-se a correlação entre PCR e VHS e índice de atividade clínica. Verificam-se discrepâncias entre seus valores e os sintomas dos pacientes, especialmente em espondilite anquilosante (EA), em que cerca de 50 a 70% dos pacientes com doença ativa apresentam elevação da PCR.36-38 Não se encontrou relação entre gravidade de entesites e VHS.38 Os maiores níveis de PCR neste grupo de doenças são vistos em paciente com EA que apresenta artrite periférica ou uveíte, questionando-se sua utilidade em pacientes sem essas manifestações.1,37,38
Com relação ao Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) - índice que monitora atividade em EA -, verificou-se maior associação a níveis de PCR do que VHS, haptoglobina ou β2-microglobulina.37,39
A dosagem da SAA pode ser mais sensível em monitorar a atividade de doença do que VHS e PCR, com boa correlação com BASDAI.36,40
Em pacientes em tratamento com infliximabe, alguns estudos mostraram boa correlação do PCR e da VHS com resposta clínica já após duas semanas da aplicação inicial, ao passo que outros verificaram baixas sensibilidade e especificidade para distinguir respondedores de não respondedores.41,42 Considera-se mais útil a utilização de ambos do que um ou outro isoladamente e, embora a correlação não seja ótima, eles não devem ser menosprezados.37,42
Febre reumática
A dosagem da AGP é de muita importância na febre reumática aguda, pois auxilia no diagnóstico, permite a monitoração evolutiva da atividade da doença (apresenta elevação mais tardia que a VHS e a PCR na história natural da doença) e sua normalização implica remissão clínica. A banda eletroforética de α2-globulinas também pode ser utilizada para acompanhamento de atividade de doença.
A presença de VHS elevada demonstra atividade da doença, mas seus níveis não se correlacionam à gravidade do quadro apresentado.43
Gota
O nível de PCR correlaciona-se ao número de articulações acometidas, à temperatura articular e ao valor da VHS. Os níveis retornam ao normal com o tratamento ou o término da inflamação.1
Arterite de células gigantes e polimialgia reumática
Caracterizam-se por grandes elevações de PCR e VHS. Há boa correlação com resposta clínica à prednisona. Postula-se que pacientes com diagnóstico firmado com menor VHS podem responder a menores doses de prednisona e entrar em remissão em menor tempo. Os valores de VHS e PCR não são determinantes para o diagnóstico da doença, mas apresentam um excelente valor preditivo negativo.44-47
Lúpus eritematoso sistêmico
Valores de PCR encontram-se normais ou discretamente elevados, mesmo naqueles pacientes com doença clinicamente ativa e VHS elevada.1 De modo semelhante, apresentam níveis de SAA mais baixos e menor incidência de amiloidose. Níveis de IL-6 têm melhor correlação com atividade clínica do que os de PCR.
Em pacientes lúpicos, níveis elevados de PCR estão mais associados a infecções, embora possam ser encontrados níveis elevados em pacientes com quadro articular (sinovite) ou serosite mais importantes. Elevações discretas da PCR em lúpus podem também estar associadas à presença de aterosclerose, já que essa proteína desempenha papel relevante na aterogênese, como previamente comentado neste artigo.2,4
CONCLUSÃO
A resposta inflamatória de fase aguda compreende alterações nos componentes humorais e celulares decorrentes de estímulos de citocinas liberadas após a injúria tecidual. A análise de marcadores envolvidos nessas reações permite acompanhar a evolução dessa resposta e é de grande utilidade no seguimento de pacientes reumatológicos. Mesmo testes simples, como a VHS, mantêm uma posição de destaque no cenário do cuidado do paciente reumatológico. Entretanto, não prescinde dos dados clínicos e resultados de outros exames complementares.
As características peculiares de cada teste e seus papéis nas doenças reumáticas são informações que devem estar embutidas no raciocínio clínico.
Espera-se que, futuramente, outros exames, já aplicados em pesquisa clínica, possam também ser utilizados para a atividade cotidiana do médico reumatologista no cuidar dos seus pacientes.
Recebido em 14/10/2008.
Aprovado, após revisão, em 03/03/2009.
Declaramos a inexistência de conflitos de interesse.
-
1Volanakis JE. Acute-phase Proteins in Rheumatic Disease. In: Koopmann WJ, Moreland LW (orgs.). Arthritis and Allied Conditions. 15 ed. Philadelphia: Lippincott Williams & Wilkins, 2005.
-
2Kushner I, Gabay C. Acute-phase Proteins and Other Systemic Responses to Inflammation. N Eng J Med 1999;340:448-54.
-
3James K. Cellular and Humoral Mediators of Inflammation: Nonspecific Humoral Response to Inflammation. In: McClatchey KD. Clinical Laboratory Medicine. 2 ed. Philadelphia: Lippincott Williams & Wilkins, 2002.
-
4de Carvalho JF, Hanaoka B, Szyper-Kravitz M, Shoenfeld Y. C-Reactive Protein and Its Implications in Systemic Lupus Erythematosus. Acta Reum Port 2007;32: 317-22.
-
5Gershov D, Kim S, Brot N, Elkon KB. C-Reactive Protein Binds to Apoptotic Cells, Protects the Cells from assembly of the Terminal Complement Components, and Sustains an Antiinflammatory Innate Immune Response: Implications for Systemic Autoimmunity. J Exp Med 2000;192:1353-63.
-
6Mold C, Baca R, Du Clos TW. Serum Amyloid P Component and C-Reactive Protein Opsonize Apoptotic Cells for Phagocytosis through Fcγ Receptors. J Autoimmun 2002;19:147-54.
-
7Atkinson JP. C-Reactive Protein: A Rheumatologist´s Friend Revisited. Arthritis Rheum 2001;44:995-6.
-
8Sheldon J. Laboratory Testing in Autoimmune Rheumatic Diseases. Best Pract Res Clin Rheumatol 2004;18:249-69.
-
9Kushner I. C-Reactive Protein Elevation can be Caused by Conditions Other than Inflammation and May Reflect Aging. Cleve Clin J Med 2001;68:535.
-
10Kavanaugh A. The Role of Laboratory in the Evaluation of Rheumatic Diseases. Clin Cornerstone 1999;2:11-25.
-
11Rifai N, Ridker PM. High-Sensitivity C-Reactive Protein: A Novel and Promising Marker of Coronary Heart Disease. Clin Chem 2001;47:403-11.
-
12Salmon JE, Roman MJ. Subclinical Atherosclerosis in Rheumatoid Arthritis and Systemic Lupus Erythematosus. Am J Med 2008;121:53-8.
-
13Collares GB, Vidigal PG. Recomendacoes para o uso da velocidade de hemossedimentacao. Rev Med Minas Gerais 2004;14:52-7.
-
14Uhlar CM, Whitehead AS. Serum Amyloid A, the Major Vertebrate Acute-Phase Reactant. Eur J Biochem 1999;265:501-23.
-
15Jense LE, Whitehead AS. Regulation of Serum Amyloid A Protein Expression during Acute-Phase Response. Biochem J 1998;334:489-503.
-
16Marhaug G, Dowton SB. Serum Amyloid A: an Acute Phase Apolipoprotein and Precursor of AA Amyloid. Baillieres Clin Rheumatol 1994;8:553-73.
-
17Hochepied T, Berger FG, Baumann H, Libert C. αl-Acid Glycoprotein: an Acute-Phase Protein with Inflammatory and Immunomodulating Properties. Cytokine Growth Factor Rev 2003;14:25-34.
-
18Fournier T, Medjoubi-N N, Pourquet D. Alpha-1-acid Glycoprotein. Biochim Biophys Acta 2000;1482:157-71.
-
19O´Connel TX, Horite TJ, Kasravi B. Understanding and Interpreting Serum Protein Electrophoresis. Am Fam Phys 2005;71:105-12.
-
20Meijvis SC, Endeman H, Geers AB, ter Borg EJ. Extremily High Serum Ferritin Levels as Diagnostic Tool in Adult-onset Still's Disease. Neth J Med 2007;65:212-4.
-
21Yamanishi H, Kimura S, Hata N, Iyama S, Kanakura Y, Iwatani Y. Evaluation of a model of latent pathologic factor in relation to serum ferritin elevation. Clin Biochem 2007;40:359-64.
-
22Schwarz-Eywill M, Heilig B, Bauer H, Breitbart A, Pezzutto A. Evaluation of Serum Ferritin as a Marker for Adult Still´s Disease Activity. Ann Rheum Dis 1992;51:683-5.
-
23Lee MH. Means Jr RT. Extremely Elevated Serum Ferritin Levels in a University Hospital: Associated Diseases and Clinical Significance. Am J Med 1995;98:566-71.
-
24Koorts AM, Viljoen M. Ferritin and Ferritin Isoforms I: Structure-Function Relationships, Synthesis, Degradation and Secretion. Arch Physiol Biochem 2007;113:30-54.
-
25Koorts AM, Viljoen M. Ferritin and Ferritin Isoforms II: Protection against Uncontrolled Cellular Proliferation, Oxidative Damage and Inflammatory Processes. Arch Physiol Biochem 2007;113:55-64.
-
26Emery P, Gabay C, Kraan M, Gomez-Reino J. Evidence-Based Review of Biologic Markers as Indicators of Disease Progression and Remission in Rheumatoid Arthritis. Rheumatol Int 2007;27:793-806.
-
27Matsui T, Kuga Y, Kaneko A, Nishino J, Eto Y, Chiba N et al. Disease Activity Score 28 (DAS28) using C-Reactive Protein Underestimates Disease Activity and Overestimates EULAR Response Criteria Compared with DAS28 Using Erythrocyte Sedimentation Rate in a Large Observational Cohort of Rheumatoid Arthritis Patients in Japan. Ann Rheum Dis 2007;66:1221-26.
-
28Paulus HE, Brahn E. Is Erythrocyte Sedimentation Rate the Preferable Measure of the Acute Phase Response in Rheumatoid Arthritis? J Rheumatol 2004;31:838-40.
-
29Shovman O, Gilburd B, Zandman-Goddard G, Sherer Y, Orbach H, Gerli R et al. The Diagnostic Utility of Anti-Cyclic Citullinated Peptide Antibodies, Matrix Metalloproteinases-3, Rheumatoid Factor, Erythrocyte Sedimentation Rate, and C-Reactive Protein in Patients with Erosive and Non-Erosive Rheumatoid Arthritis. Clin Dev Immunol 2005;12:197-202.
-
30Young-Min S, Cawston T, Marshall N, Coady D, Christgau S, Saxne T et al. Biomarkers Predict Radiographic Progression in Early Rheumatoid Arthritis and Perform Well Compared with Traditional Markers. Arthritis Rheum 2007;56:3236-47.
-
31Ateþ A, Türkçapar N, Olmez U, Tiryaki O, Düzgün N, Uðuz E et al. Serum Pro-Matrix Metalloproteinase-3 as an Indicator of Disease Activity and Severity in Rheumatoid Arthritis: Comparison with Traditional Markers. Rheumatol Int 2007;27:715-22.
-
32Hameed B, Pilcher J, Heron C, Kiely PD. The Relation between Composite Ultrasound Measures and the DAS28 Score, its Components and Acute Phase Markers in Adult RA. Rheumatology 2008;47:476-80.
-
33Badolato R, Oppenheim JJ. Role of Cytokines, Acute-Phase Proteins, and Chemokines in the Progression of Rheumatoid Arthritis. Semin Arthritis Rheum 1996;26:526-38.
-
34Vignes S, Le Moël G, Fautrel B, Wechsler B, Godeau P, Piette JC. Percentage of Glycosilated Serum Ferritin Remains Low Throughout the Course of Adult-Onset Still’s Disease. Ann Rheum Dis 2000;59:347-50.
-
35Hamidou MA, Denis M, Barbarot S, Boutoille D, Belizna C, Le Moël G. Usefulness of Glycosilated Ferritin in Atypical Presentations of Adult-onset Still’s Disease (letter). Ann Rheum Dis 2004;63:605.
-
36Jung SY, Park MC, Park YB, Lee SK. Serum Amyloid A as a Useful Indicator of Disease Activity in Patients with Ankylosing Spondylitis. Yonsei Med J 2007;48:218-24.
-
37Ozgocmen S, Godekmerdan A, Ozkurt-Zengin F. Acute-Phase Response, Clinical Measures and Disease Activity in Ankylosing Spondylitis. Joint Bone Spine 2007;74:249-53.
-
38Kaya T, Bal S, Gunaydin R. Relationship between the Severity of Enthesitis and Clinical and Laboratory Parameters in Patients with Ankylosing Spondylitis. Rheumatol Int 2007;27:323-7.
-
39Yildirim K, Erdal A, Karatay S, Melikoðlu MA, Uður M, Senel K. Relationship Between Some Acute Phase Reactants and the Bath Ankylosing Spondylitis Disease Activity Index in Patients with Ankylosing Spondylitis. South Med J 2004;97:350-3.
-
40Lange U, Boss B, Teichmann J, Klör HU, Neeck G. Serum Amyloid A: an Indicator of Inflammation in Ankylosing Spondylitis. Rheumatol Int 2000;19:119-22.
-
41Visvanathan S, Marini JC, Smolen JS, Clair EW, Pritchard C, Shergy W et al. Inflammatory Biomarkers, Disease Activity and Spinal Disease Measures in Patients with Ankylosing Spondylitis after Treatment with Infliximab. Ann Rheum Dis 2008;67:511-17.
-
42Romero-Sánchez C, Robinson WH, Tomooka BH, Londoño J, Valle-Oñate R, Huang F et al. Identification of Acute Phase Reactants and Cytokines Useful for Monitoring Infliximab Therapy in Ankylosing Spondylitis. Clin Rheumatol 2008;27:1429-35.
-
43Roodpeyma S, Kamali Z, Zare R. Rheumatic Fever: The Relationship Between Clinical Manifestations and Laboratory Tests. J Pediatr Child Health 2005;41:97-100.
-
44Ellis ME, Ralston S. The ESR in the Diagnosis and Management of the Polymyalgia Rheumatica/Giant-cell Arteritis Syndrome. Ann Rheum Dis 1983;42:168-70.
-
45Helfgot S, Kieval RI. Polymyalgia Rheumatica in Patients with a Normal Erythrocyte Sedimentation Rate. Arthritis Rheum 1996;39:304-7.
-
46Caliani L, Paira SO. Polymyalgia Rheumatica in Patients with a Normal Erythrocyte Sedimentation Rate: Comment on the Article by Helgot and Kieval. Arthritis Rheum 1997;40:1725-6.
-
47Cimmino MA, Accardo S, Scudeletti M, Indiveri F. The Diagnosis of Polymyalgia Rheumatica in Patients with a Low Erythrocyte Sedimentation Rate: Comment on the Article by Helfgot and Kieval (letter). Arthritis Rheum 1997;40:1726-7.
-
48Gitlin JD, Colten HR. Molecular Biology of the Acute-Phase Plasma Proteins. In: Pick E, Landy M (orgs.). Lymphokines. v. 14. San Diego: Academic Press, 1987.
Datas de Publicação
-
Publicação nesta coleção
04 Ago 2009 -
Data do Fascículo
Ago 2009
Histórico
-
Aceito
03 Mar 2009 -
Recebido
14 Out 2008