Abstract
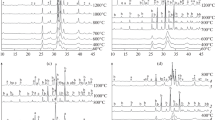
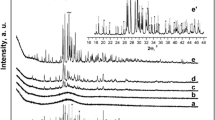
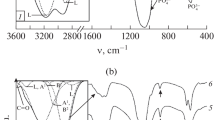
Previous studies have indicated that synthetically-precipitated amorphous calcium phosphate, even though not a periodically regular structure, possesses a chemically definable local unit of structure. The present paper is a report of thermochemical studies performed to more clearly define this local chemical unit. Upon ignition in the absence of water, freezedried amorphous calcium phosphate preparations converted into crystalline α-and/or β-tricalcium phosphates. At temperatures just below the crystallization point, the amorphous calcium phosphate became almost completely dehydrated. Additionally, pyrophosphate production at these subcrystallization temperatures was very low. From these data, it appears that water in amorphous calcium phosphate does not exist in combination with the P2O5 component as acid phosphate but retains its molecular identity, suggesting, together with previously reported chemical data, that amorphous calcium phosphate when formed under specific chemical conditions is a hydrated tricalcium phosphate.
Résumé
Des études antérieures ont montré que le phosphate de calcium amorphe précipité, de facon synthétique, bien que ne présentant pas une structure périodique régulière, présente cependant une structure chimiquement définie. Le présent travail est consacré à des études thermo-chimiques destinées à définir plus clairement une telle structure. Au cours d'ignifugation en l'absence d'eau, les préparations de phosphate de calcium amorphe, après congélationdessication, se transforment en phosphates tricalciques cristallins α et β. A des températures situées immédiatement au-dessous du point de cristallisation, le phosphate de calcium amorphe se déshydrate presqu'en totalité. En plus, la production de pyrophosphate à ces températures de subcristallisation est très basse. D'après ces résultats, il apparait que l'eau du phosphate de calcium amorphe n'existe pas en combinaison avec le composant P2O5, en tant que phosphate acide, mais conserve son identité moléculaire. Ce fait semble indiquer, en accord avec des résultats chimiques antérieures, que le phosphate de calcium amorphe est un phosphate tricalcique hydraté, lorsqu'il est obtenu dans des conditions chimiques spécifiques.
Zusammenfassung
Frühere Untersuchungen haben gezeigt, daß künstlich gefälltes, amorphes Calciumphosphat eine chemisch definierbare Struktureinheit besitzt, obschon diese nicht periodisch einheitlich ist. Die vorliegende Arbeit beschreibt thermochemische Untersuchungen, die zur besseren Definierung dieser chemischen Struktur durchgeführt wurden. Durch Erhitzen in Abwesenheit von Wasser verwandelten sich gefriergetrocknete amorphe Calciumphosphatproben in kristallines α-und/oder β-Tricalciumphosphat. Bei Temperaturen gerade unter dem Kristallisationspunkt wurde das amorphe Calciumphosphat beinahe vollständig dehydriert. Dazu war die Pyrophosphatbildung bei diesen Temperaturen sehr gering. Aus diesen Resultaten zu schließen, scheint es, daß das Wasser im amorphen Calciumphosphat nicht in Verbindung mit der P2O5-Komponente als saures Phosphat besteht, sondern seine molekulare Identität beibehält. Dies läßt vermuten, gestützt auch auf früher mitgeteilte chemische Ergebnisse, daß unter spezifisch chemischen Bedingungen gebildetes amorphes Calciumphosphat ein hydriertes Tricalciumphosphat ist.
Similar content being viewed by others
References
Berry, E. E., Leach, S. A.: The structure of some calcium deficient apatites. Arch. oral Biol12, 171–174 (1967).
Eanes, E. D., Gillessen, I. H., Posner, A. S.: Intermediate states in the precipitation of hydroxyapatite. Nature (Lond.)208, 365–367 (1965).
———: Mechanism of conversion of non-crystalline calcium phosphate to crystalline hydroxyapatite. In: Crystal growth (H. S. Peiser, ed.), p. 373–376. New York: Pergamon Press 1967.
Eanes, E. D., Harper, R. A., Gillessen, I. H., Posner, A. S.: An amorphous component in bone mineral. In: Fourth European Symposium on Calcified Tissues (P. J. Gaillard, A. van den Hoff, and R. Steendijk, eds.), p. 24–26. Internat. Congr. Series No 120. Amsterdam: Excepta Medica 1966.
—, Posner, A. S.: Kinetics and mechanism of conversion of non-crystalline calcium phosphate to crystalline hydroxyapatite. Trans. N.Y. Acad. Sci.28, 233–241 (1965).
——: Intermediate phases in the basic solution preparation of alkaline earth phosphates. Calc. Tiss. Res.2, 38–48 (1968).
Fleisch, H., Russell, R. G. G., Bisaz, S. Termine, J. D., Posner, A. S.: Influence of pyrophosphate on the transformation of amorphous to crystalline calcium phosphate. Calc. Tiss. Res.2, 49–59 (1968).
Fowler, B. O., Moreno, E. C., Brown, W. E.: Infra-red spectra of hydroxyapatite, octacalcium phosphate and pyrolysed octacalcium phosphate. Arch. oral Biol.11, 477–492 (1966).
Gee, A., Deitz, V. R.: Determination of phosphate by differential spectrophotometry. Anal. Chem.25, 1320–1324 (1953).
——: Pyrophosphate formation upon ignition of precipitated basic calcium phosphates. J. Amer. chem. Soc.77, 2961–2965 (1955).
Harper, R. A., Posner, A. S.: Measurement of non-crystalline calcium phosphate in bone mineral. Proc. Soc. exp. Biol. (N.Y.)122, 137–142 (1966).
Herman, H., Francois, P., Fabry, C.: Le composé minéral fondamental des tissus calcifiés. I. Présence de groupements acides dans le réseau apatitique des phosphates de calcium synthétiques. Bull. Soc. Chim. biol. (Paris)43, 629–642 (1961).
Kolthoff, I. M., Sandell, E. B.: Textbook of quantitative inorganic analysis, 3rd ed. New York: Macmillan 1952.
Termine, J. D., Posner, A. S.: Amorphous/Crystalline interrelationships in bone mineral. Calc. Tiss. Res.1, 8–23 (1967).
Trautz, O. R.: X-ray diffraction of biological and synthetic apatites. Ann. N.Y. Acad. Sci.60, 696–712 (1955).
—, Fessenden, E.: Formation and stability of whitlockite and octacalcium phosphate, two components of salivary calculi. J. dent. Res.37, 78–79 (1958).
Walton, A. G.: The nucleation of sparingly soluble salts from solution. Anal. chim. Acta29, 434–441 (1963).
Wazer, J. R. van: Phosphorus and its compounds, vol. I: Chemistry, p. 527. New York: Interscience 1958.
Weber, J. C., Eanes, E. D., Gerdes, R. J.: Electron microscope study of noncrystalline calcium phosphate. Arch. Biochem.120, 723–724 (1967).
Winand, L.: Étude physio-chimique du phosphate tricalcique hydrate et de l'hydroxylapatite. Ann. Chim.6, 941–967 (1961).
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Eanes, E.D. Thermochemical studies on amorphous calcium phosphate. Calc. Tis Res. 5, 133–145 (1970). https://doi.org/10.1007/BF02017543
Received:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF02017543