Resumos
A síndrome dos ovários policísticos é uma das endocrinopatias mais comuns, afetando aproximadamente 7% das mulheres na idade reprodutiva. Embora tenha sido descrita em 1935, somente em 1990 foi elaborado o primeiro consenso com relação ao seu diagnóstico. Hoje, a síndrome é considerada também um fator de risco cardiovascular, com uma alta prevalência de distúrbios metabólicos. Como reflexo dessa nova visão da síndrome, vários documentos, entre Consensos, Posicionamentos e Orientações, têm sido publicados, abordando diversos aspectos da síndrome. O objetivo desta revisão é uma análise crítica desses documentos, obtidos mediante um levantamento na base PubMed, por meio dos unitermos polycystic ovary syndrome, hyperandrogenism e hirsutism, separadamente, tendo como limitador o termo Type of Article (Practice Guideline, Consensus Development Conference, Guideline), sem limitação de data, língua e idade. Foram selecionados apenas os documentos elaborados sob patrocínio de Entidades Médicas e com mais de um autor.
Síndromes hiperandrogênicas; hirsutismo; síndrome dos ovários policísticos
The polycystic ovary syndrome is one of the most common endocrinopathies, affecting approximately 7% of women of reproductive age. Although it was described in 1935, only in 1990 was published the first Consensus regarding it its diagnosis. Today, the syndrome is also considered a cardiovascular risk factor, with a high prevalence of metabolic disorders. Reflecting this new vision of the syndrome, several documents, including Consensus, Statement and Guidelines have been published, addressing different aspects of the syndrome. This review is an analysis of documents obtained through a survey in the PubMed database, using the keywords "polycystic ovary syndrome", "hyperandrogenism" and "hirsutism", separately, taking as limiting the term Type of Article (Practice Guideline, Consensus Development Conference, Guideline) without limitation of time, language and age, having been selected only those documents prepared under the sponsorship of Medical Entities and with more than one author.
Hyperandrogenic syndromes; hirsutism; polycystic ovary syndrome
REVISÃO
Dificuldades e armadilhas no diagnóstico da síndrome dos ovários policísticos
Difficulties and pitfalls in the diagnosis of polycystic ovary syndrome
José Antonio Miguel Marcondes; Cristiano Roberto Grimaldi Barcellos; Michelle Patrocínio Rocha
Serviço de Endocrinologia, Hospital das Clínicas de São Paulo, São Paulo, SP, Brasil
Correspondência para Correspondência para: José Antonio Miguel Marcondes Rua Baronesa de Itu, 821, ap. 112 01231-001 -São Paulo, SP, Brasil marcondesmd@uol.com.br
SUMÁRIO
A síndrome dos ovários policísticos é uma das endocrinopatias mais comuns, afetando aproximadamente 7% das mulheres na idade reprodutiva. Embora tenha sido descrita em 1935, somente em 1990 foi elaborado o primeiro consenso com relação ao seu diagnóstico. Hoje, a síndrome é considerada também um fator de risco cardiovascular, com uma alta prevalência de distúrbios metabólicos. Como reflexo dessa nova visão da síndrome, vários documentos, entre Consensos, Posicionamentos e Orientações, têm sido publicados, abordando diversos aspectos da síndrome. O objetivo desta revisão é uma análise crítica desses documentos, obtidos mediante um levantamento na base PubMed, por meio dos unitermos polycystic ovary syndrome, hyperandrogenism e hirsutism, separadamente, tendo como limitador o termo Type of Article (Practice Guideline, Consensus Development Conference, Guideline), sem limitação de data, língua e idade. Foram selecionados apenas os documentos elaborados sob patrocínio de Entidades Médicas e com mais de um autor.
Descritores: Síndromes hiperandrogênicas; hirsutismo; síndrome dos ovários policísticos
SUMMARY
The polycystic ovary syndrome is one of the most common endocrinopathies, affecting approximately 7% of women of reproductive age. Although it was described in 1935, only in 1990 was published the first Consensus regarding it its diagnosis. Today, the syndrome is also considered a cardiovascular risk factor, with a high prevalence of metabolic disorders. Reflecting this new vision of the syndrome, several documents, including Consensus, Statement and Guidelines have been published, addressing different aspects of the syndrome. This review is an analysis of documents obtained through a survey in the PubMed database, using the keywords "polycystic ovary syndrome", "hyperandrogenism" and "hirsutism", separately, taking as limiting the term Type of Article (Practice Guideline, Consensus Development Conference, Guideline) without limitation of time, language and age, having been selected only those documents prepared under the sponsorship of Medical Entities and with more than one author.
Keywords: Hyperandrogenic syndromes; hirsutism; polycystic ovary syndrome
INTRODUÇÃO
A síndrome dos ovários policísticos (SOP) foi descrita inicialmente por Stein e Leventhal, em 1935 (1), os quais observaram uma associação entre amenorreia, hirsutismo e obesidade com ovários de aspecto policístico. Estes eram aumentados de volume bilateralmente, com cápsulas espessadas e esbranquiçadas e com múltiplos cistos de localização preferencialmente subcapsular e estroma denso e hipertrófico.
Subsequentemente, a heterogeneidade dos achados histológicos e das características clínicas levou à adoção do termo "síndrome dos ovários policísticos". Com a introdução de novas técnicas de investigação, o que antes era um diagnóstico baseado apenas em aspectos clínicos e anatômicos passou a incorporar critérios bioquímicos e ultrassonográficos (2). Se, por um lado, esses avanços amplificaram o campo de pesquisa, possibilitando novas descobertas que se constituem numa diversidade de achados para essa síndrome, por outro, dificultou a obtenção de um critério diagnóstico que fosse aceito universalmente pelos estudiosos do tema.
Nesses últimos anos, vários documentos, entre Consensus, Guidelines, Position Statement e Practice Bulletin, foram elaborados por sociedades médicas com a finalidade de uniformizar os critérios diagnósticos da síndrome (3-15).
O objetivo desta revisão é o de sintetizar e analisar esses documentos, salientando as dificuldades e armadilhas envolvidas na aplicação dos critérios fundamentais para o diagnóstico da SOP. Para tanto, foram pesquisados na base de dados MEDLINE os unitermos hyperandrogenism, polycystic ovary syndrome e hirsutism, separadamente, tendo como limitador o termo Type of Article (Practice Guideline, Consensus Development Conference, Guideline), sem limitação de data, língua e idade. Foram selecionados apenas os que foram publicados com aval de Sociedades Médicas e com mais de um autor. A pesquisa dos termos síndrome dos ovários policísticos e hirsutismo, separadamente, na base de dados SciELO não resultou em nenhum artigo que se enquadrasse nos unitermos pesquisados na base de dados MEDLINE. Embora não tenha sido identificado no levantamento realizado por meio do PubMed, possivelmente por ter sido publicado sob a forma de capítulo de livro, o documento elaborado pelo The National Institute of Health Consensus Conference (3) sobre critérios diagnósticos da SOP também foi considerado, por se tratar do primeiro Consenso a abordar o tema.
CONCEITO E CONSENSOS
Um ponto concordante dos consensos sobre critérios diagnósticos é que se trata de uma síndrome e não de uma doença específica. De acordo com a raiz grega de sua palavra, síndrome é uma associação de características (sinais, sintomas e fenômenos) que ocorrem frequentemente juntas, sendo que a presença de uma característica alerta para a presença de outra e a razão pela qual ocorrem em conjunto é desconhecida. Consequentemente nenhum critério isolado é suficiente para seu diagnóstico clínico, sendo, portanto, um diagnóstico de exclusão, ou seja, doenças que mimetizam seu fenótipo devem ser excluídas.
No que se refere à SOP, suas características fundamentais são constituídas por disfunção menstrual, hiperandrogenismo, hiperandrogenemia e ovários policísticos.
Uma definição clínica e prática para a síndrome foi elaborada pelo National Institutes of Health (Consenso do NIH), em 1990 (3) (Tabela 1). De acordo com esse documento, a SOP seria consequente a um quadro de anovulação crônica hiperandrogênica, devendo ser definida pela presença de disfunção menstrual e excesso androgênico, que pode ser de ordem clínica (hiperandrogenismo) ou laboratorial (hiperandrogenemia).
Posteriormente, dois outros Consensos foram elaborados, sendo um deles em 2003 pela European Society of Human Reproduction and Embryology/American Society of Reproductive Medicine (Consenso de Rotterdam) (8,9) e o outro em 2006 pela The Androgen Excess and PCOS Society (AE-PCOS Society) (11,12). O Consenso de Rotterdam considerou que a SOP ocorre em virtude da produção aumentada de andrógenos pelo ovário (atresia folicular com anovulação associada ao hiperandrogenismo e hiperandrogenemia). Além disso, considerou que a síndrome pode se manifestar pelos fenótipos mais amplos do que os contemplados pelo critério do Consenso do NIH (3). Por esse motivo, é sugerido nesse consenso que a presença de dois dos três critérios seguintes são suficientes para o diagnóstico da síndrome: 1. Oligo e/ou anovulação; 2. Evidências clínicas ou laboratoriais de hiperandrogenismo e 3. Presença de ovários policísticos à ultrassonografia.
De acordo com esse critério, dois fenótipos passaram a ser compatíveis com o diagnóstico da SOP: pacientes com evidências clínicas ou laboratoriais de hiperandrogenismo associados com ovários policísticos, mas sem disfunção menstrual; e pacientes com disfunção menstrual e ovários policísticos, mas sem a presença de hiperandrogenismo ou hiperandrogenemia.
Enquanto no Consenso de Rotterdam a morfologia ovariana policística à ultrassonografia é colocada como um dos critérios isolados para o diagnóstico da síndrome, no Position Statement da AE-PCOS Society (11,12) o excesso androgênico deve estar obrigatoriamente presente, seja pela hiperandrogenemia, seja pelo hiperandrogenismo. Segundo esse posicionamento para o diagnóstico da síndrome, são necessários dois dos critérios seguintes: 1. Oligo e/ou anovulação ou ovários policísticos à ultrassonografia; 2. Evidências clínicas ou laboratoriais de excesso androgênico.
Para chegar a esses critérios, considerou-se a síndrome como uma desordem de excesso androgênico por todas suas características fundamentais: disfunção menstrual ou ovulatória, hiperandrogenemia, hiperandrogenismo e ovários policísticos; além disso, o Position Statement da AE-PCOS Society salientou que os fenótipos resultantes da combinação dessas características, como grupo, mas não necessariamente individualmente, apresentam risco de resistência à insulina e suas consequentes anormalidades metabólicas.
Na realidade, esses dois Consensos não substituem o Consenso do NIH com seu fenótipo clássico, mas sim expandem o número de fenótipo possível para a síndrome, sendo 6 de acordo com os critérios do Consenso do NIH (3), 10 do Consenso de Rotterdam (8,9) e 9 pela AE-PCOS Society (8,9).
Uma dificuldade particular no diagnóstico da síndrome dos ovários policísticos refere-se à aplicação desses documentos em pacientes adolescentes. Além de dificuldades de ordem técnica e da ausência de dados normativos, alguns dos componentes fundamentais da síndrome podem estar presentes, mas serem transitórios.
ASPECTOS DO DIAGNÓSTICO
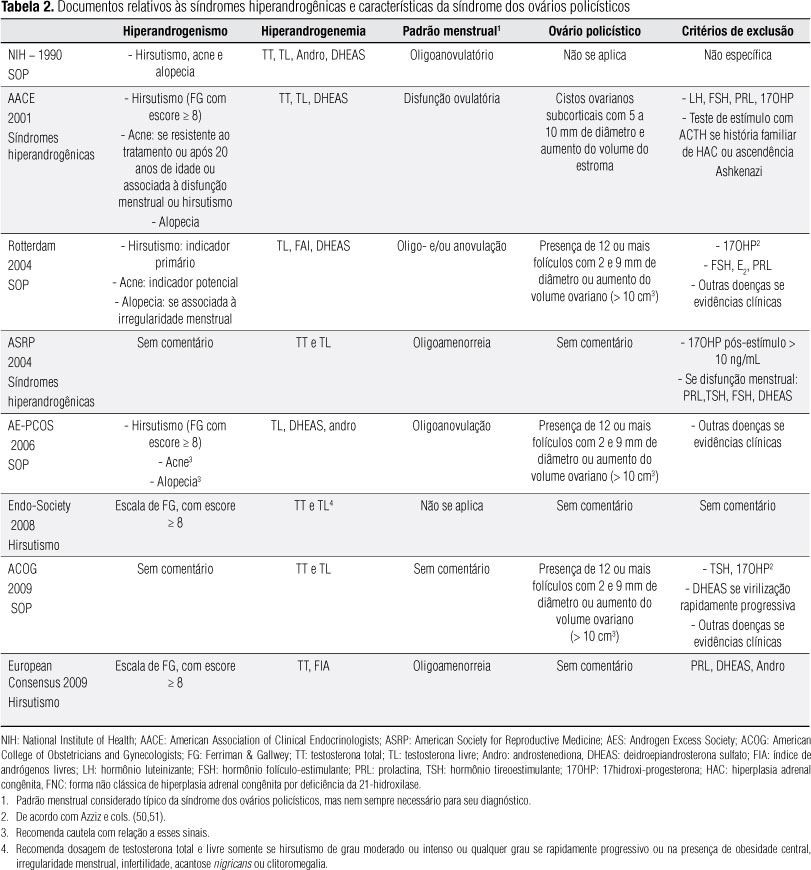
Uma variedade de combinação de sinais e sintomas, bem como de alterações ultrassonográficas e laboratoriais, é a regra em pacientes portadoras da síndrome (Tabela 2). Essas diferentes manifestações podem ser decorrentes de características genéticas da população, da presença da obesidade e do impacto da resistência à insulina.
Hiperandrogenismo
Manifestações clínicas de hiperandrogenismo encontradas em pacientes com a síndrome incluem o hirsutismo, a acne e a alopecia androgênica. Enquanto o hirsutismo é reconhecidamente um sinal de excesso androgênico (16,17), o significado da acne e da alopecia androgênica não está adequadamente estabelecido. Embora a acne possa estar presente em aproximadamente 20% das pacientes (18-20), não está clara a prevalência de hiperandrogenemia em pacientes com acne isolada, motivo pelo qual esse sinal deve ser valorizado com cautela quando estiver presente isoladamente. Como pode se observar na tabela 2, esse sinal é valorizado pelos diversos documentos, sendo que a American Association of Clinical Endocrinologists (AACE) sugere que deva ser considerado somente em situações especiais (se resistente ao tratamento ou após 20 anos de idade ou associada à disfunção menstrual) (4). Uma dificuldade adicional quanto à valorização da acne como evidência de excesso androgênico ocorre na adolescente, na qual este é um sinal comum, com uma incidência de quase 90% (21), com possibilidade de regredir após a terceira década de vida (22).
A alopecia androgênica pode ser encontrada em até 5% das pacientes com a síndrome, sendo citada como uma manifestação de excesso androgênico por quatro Sociedades (3,4,8,9,11,12). Entretanto, o Consenso de Rotterdam salienta que é um marcador pobre para hiperandrogenismo caso não esteja presente o distúrbio menstrual (23).
Com relação ao hirsutismo, sua presença tem sido identificada pelo emprego da escala de Ferriman e Gallwey (24). De acordo com a publicação original, a presença e a quantidade de pelos foram avaliadas em uma escala de 0 a 4 em onze áreas corporais. Esses autores observaram que em mulheres jovens uma quantidade significativa de pelos foi encontrada em braços e pernas, enquanto nas demais áreas a quantidade foi quase nula. A partir dessa observação, propuseram que um escore poderia ser obtido pela quantificação dos pelos em nove das onze áreas avaliadas (com exclusão da perna e braço). Essa escala que considera apenas essas nove áreas tem sido referida como sendo de Ferriman e Gallwey modificada (25).
Uma limitação importante do emprego da escala de Ferriman e Gallwey diz respeito à sua reprodutibilidade quando empregada por observadores independentes. Enquanto a variabilidade intraobservador é menor de 3 pontos (26), a variabilidade interobservador chega a 50%, dependendo da área considerada (27). Assim, essa escala dessa ser utilizada por um mesmo observador, sendo desaconselhável seu uso quando da avaliação por vários observadores.
Entretanto, a principal limitação para o emprego da escala de Ferriman e Gallwey consiste na determinação do ponto de corte considerado normal, levando-se em consideração inclusive a raça das mulheres estudadas. Sabe-se, por exemplo, que o hirsutismo é significativamente menos prevalente em mulheres asiáticas e adolescentes (28). Apesar de Ferriman ter proposto, em uma publicação posterior, que o limite de corte deveria ser igual ou maior que 5 (29), o limite de corte utilizado tem sido igual ou maior que 8 (Tabela 2), o que representa o percentil 95 dos dados originariamente publicados por Ferriman e Gallwey (24). Mais recentemente, um limite de corte de 3 foi proposto por DeUgarte e cols. em um estudo realizado em mulheres americanas (30). Além de demonstrar que não houve diferença entre brancas e negras, observaram que a porcentagem de mulheres com um limite de corte maior ou igual a 3 que se queixavam de excesso de pelos (69,3%) foi igual à das mulheres com um limite de corte maior ou igual a 8 (70%), enquanto a porcentagem de mulheres com um limite de corte menor que 3 que se queixavam de excesso de pelos foi de 15,8%.
Esse dado está de acordo com os resultados do estudo de Souter e cols., que observaram que, em mulheres com um escore de 1 a 5, 55% apresentavam uma síndrome de excesso androgênico, principalmente SOP (31). Das pacientes com irregularidade menstrual, 65% apresentaram uma desordem de excesso androgênico, contra 22% das pacientes com ciclos menstruais regulares. Das pacientes eumenorreicas, somente 11% apresentaram uma síndrome de excesso androgênico.
Contrariando essa observação sobre a conveniência da redução do limite de corte, o Guideline da Endocrine Society (13) sugere que pacientes com hirsutismo de grau leve (escore de Ferriman e Gallwey < 15) não devam ser avaliadas, pois considera que a possibilidade de se identificar uma etiologia que possa modificar a conduta terapêutica é pequena. O hirsutismo seria avaliado se de grau moderado ou severo ou de qualquer grau quando de início súbito, rapidamente progressivo ou quando associado à irregularidade menstrual ou infertilidade, obesidade central, acantose nigricans ou na presença de clitoromegalia. Se considerarmos que tanto o Consenso de Rotterdam quanto o Position Statement da AE-PCOS Society admitem a existência de SOP em pacientes com ciclos menstruais regulares, ovulatórios ou não, investigar pacientes com hirsutismo com escore < 15 somente se estiver presente a irregularidade menstrual poderá deixar de identificar pacientes com a síndrome.
Hiperandrogenemia
Níveis elevados de andrógenos são encontrados em aproximadamente 60% a 80% das pacientes com SOP, sendo representado principalmente por um valor aumentado de testosterona livre, enquanto a dosagem isolada da testosterona total contribui pouco para o diagnóstico (32). Concentração aumentada de DHEAS pode ser encontrada em 25% das pacientes (33), podendo ser este o único andrógeno alterado em 10% das pacientes (34). A contribuição da dosagem de androstenediona é discutível, mas ela pode aumentar o número de pacientes diagnosticadas como hiperandrogênicas em 10% (34). Já a dosagem da DHEA tem um valor diagnóstico limitado, não sendo sugerida sua determinação na avaliação rotineira em pacientes com síndromes hiperandrogênicas.
Como se pode observar na tabela 2, testosterona total e testosterona livre são os principais andrógenos considerados como úteis para identificação da hiperandrogenemia, sendo que apenas três dos oito documentos relacionados sugerem a dosagem de DHEAS e dois, a de androstenediona. A dosagem da testosterona livre ou o cálculo do índice de testosterona livre são sugeridos em todos os documentos.
Segundo o Consenso de Rotterdam, algumas limitações devem ser consideradas com relação à dosagem de testosterona (8,9): substâncias esteroides de estrutura similar na circulação podem levar à interferência; a faixa de normalidade na população geral é ampla, da ordem de três magnitudes; a concentração de testosterona varia durante o dia; ausência de valores de referência estabelecidos para cada população e sexo, principalmente para adolescentes e idosos; a faixa etária e o índice de massa corporal não têm sido levados em conta na interpretação dos resultados; não há um padrão universal de referência para a dosagem de testosterona.
Vários métodos encontram-se disponíveis para a dosagem de testosterona total, sendo os mais utilizados o radioimunoensaio e o enzimaimunoensaio. Entretanto, o coeficiente de variação é significativo (entre 10% e 20%), sendo tanto maior quanto menor a concentração de testosterona, principalmente para valores inferiores a 250 ng/dL (35). Para uma mesma amostra, dosadas em laboratórios diferentes, pode haver uma variação da concentração da ordem de 2 a 6 vezes (35).
Embora o padrão-ouro para a dosagem de testosterona livre seja o método de diálise de equilíbrio, na prática clínica utiliza-se a fórmula de Vermeulen (36), por meio da qual se obtém a testosterona livre a partir das concentrações da testosterona total e da globulina ligadora de esteroides sexuais (SHBG).
Levando-se em consideração essas observações, é preciso cautela para se valorizar um aumento da concentração de testosterona em pacientes sem sinais clínicos de excesso androgênico.
Disfunção menstrual
Uma variedade de termos tem sido empregada pelos documentos para caracterizar a disfunção menstrual nas pacientes com a síndrome: anovulação crônica (NIH) (3), oligo e/ou anovulação (Rotterdam) (8,9) e oligoanovulação (AE-PCOS Society) (11,12). Se para o National Institute of Health a presença da anovulação crônica (amenorreia ou espaniomenorreia) é essencial para o diagnóstico da SOP, pacientes com ciclos menstruais regulares e até mesmo ovulatório podem ser diagnosticadas como portadoras da síndrome pelos dois outros consensos.
Uma minoria de pacientes pode apresentar uma variante da síndrome caracterizada pela presença de ovulação (ovulatory PCOS). Nesta variante, cuja história natural não se sabe ao certo, observam-se anormalidades androgênicas e distúrbios metabólicos menos intensos (37,38). Enquanto uma história de ciclos menstruais regulares em uma paciente com ausência de hiperandrogenismo é fortemente sugestiva de ovulação, a presença de sinais de hiperandrogenismo pode indicar ciclos anovulatórios. Nessa situação, tanto o Position Statement da AE-PCOS Society (11,12) quanto o posicionamento da American Association of Reproductive Medicine (10) orientam para a dosagem da progesterona entre os 20º e 24º dias do ciclo menstrual.
Em adolescentes, alterações menstruais e ciclos anovulatórios são comuns, podendo estar presentes em até 65% das meninas (39). Embora um intervalo de 45 dias tenha sido considerado como normal até dois a três anos após a menarca, um estudo demonstrou que 98% das adolescentes com ciclos com intervalo de 21 a 34 dias aos 15 anos mantiveram o padrão menstrual regular aos 18 anos de idade. Já nas adolescentes com ciclos com intervalo maior que 34 dias aos 15 anos, apenas 49% apresentaram ciclos menstruais regulares aos 18 anos (39). Nesse estudo, o melhor preditor para distúrbio menstrual aos 18 anos de idade foi a presença de oligomenorreia na adolescência. Esses dados demonstram a dificuldade na valorização do distúrbio menstrual na adolescente, uma vez que metade pode regularizar o ciclo na idade adulta.
O ovário policístico
A identificação do ovário policístico deve obedecer a critérios diagnósticos estritos e não somente se apoiar na aparência multicística ou policística do ovário. Isso foi possível a partir do emprego do ultrassom de alta resolução em tempo real por Swanson e cols., em 1981 (40), que permitiu detectar cistos e folículos ovarianos em condições normais e patológicas. Segundo esses autores, o ovário policístico é caracterizado por ovários aumentados de volume contendo um grande número de folículos com 2 a 6 mm de diâmetro, não se fazendo referência ao número de folículos nem às características do estroma. Posteriormente, Adams e cols. definiram a morfologia policística como sendo a de um ovário que continha pelo menos 10 folículos, geralmente entre 2 e 8 mm de diâmetro, dispostos perifericamente ou espalhados em um estroma denso e hipertrófico (41). Alternativamente, e menos frequentemente, podem ser identificados múltiplos cistos, com 2 a 4 mm de diâmetro, distribuídos em um estroma abundante (41). Mais recentemente, a utilização da via transvaginal se acompanhou de um aumento da sensibilidade do exame, ao permitir uma visualização mais precisa do ovário, principalmente em mulheres obesas (42).
Como pode ser observado na tabela 2, o critério de morfologia ovariana policística no ultrassom diverge entre os vários documentos. O Guideline da AACE adota o critério proposto por Adams e cols. (41). Posteriormente, e apesar de o aumento da ecogenicidade do estroma ter sido descrito inicialmente como uma das características do ovário policístico, o Consenso de Rotterdam (8,9) adotou a sugestão de um Consenso internacional sobre avaliação ultrassonográfica do ovário policístico de que esse aspecto, assim como a distribuição periférica dos cistos, fosse omitido, considerando dificuldades técnicas para sua identificação (7). De fato, não há um critério definido para definir a hiperplasia do estroma (43), sendo este um critério subjetivo (44). Por outro lado, foi demonstrado que o volume ou área do ovário tem uma boa correlação com o volume do estroma (7). De acordo com esse Consenso Internacional, o ovário policístico deve ser definido pela presença de 12 ou mais folículos medindo entre 2 e 9 mm de diâmetro e/ou aumento do volume ovariano (> 10 cm3). Essa definição é também recomendada pelos documentos que se seguiram ao do Consenso de Rotterdam (13,14,20,22), não se aplicando a mulheres em uso de contraceptivo hormonal oral. Algumas considerações adicionais propostas pelo Consenso de Rotterdam incluem: em mulheres com ciclos menstruais regulares, a ultrassonografia deve ser realizada na fase folicular precoce, enquanto em pacientes com distúrbio menstrual pode ser realizada aleatoriamente ou após três a cinco dias de fluxo menstrual induzido pela administração de progesterona; a via transvaginal deve ser preferencialmente utilizada, principalmente em mulheres obesas; se houver evidência de um folículo dominante (> 10 mm), a ultrassonografia deve ser repetida; o cálculo do volume ovariano deve ser realizado pela fórmula: 0,5 x comprimento x largura x espessura (40); o número de folículos deve ser estimado tanto em corte longitudinal quanto transversal; o diâmetro dos folículos deve ser expresso como a média de três diâmetros, longitudinal, transversal e anteroposterior e a ultrassonografia é uma oportunidade para o rastreamento de hiperplasia endometrial e câncer de ovário.
É importante salientar que, embora a morfologia ovariana policística ao ultrassom possa ser encontrada em aproximadamente 75% das pacientes com SOP (7), o Position Statement da AE-PCOS Society (11,12) chama a atenção que essa morfologia pode ser encontrada em até 20% de mulheres normais. O seguimento de 24 dessas mulheres por um período de oito anos demonstrou que somente uma evoluiu para a síndrome, enquanto das restantes metade manteve a morfologia e metade apresentou regressão desta (45).
Em adolescentes, a avaliação morfológica do ovário pela ultrassonografia é feita em geral pela via transabdominal, com uma perda de sensibilidade do exame (42,44). Embora não exista um Consenso específico sobre critérios para diagnóstico do ovário policístico nessa faixa etária, van Hooff e cols. demonstraram que os melhores parâmetros para diferenciar o ovário normal do ovário policístico foram o número de folículos (10 ou mais cistos em ambos os ovários) e o volume ovariano (11,8 cm3, correspondente ao percentil 95 de adolescentes com ciclos menstruais regulares) (39). Esses critérios estiveram presentes em apenas 9% de adolescentes com ciclos menstruais regulares, aumentando sua incidência de acordo com a piora do padrão menstrual (28% na presença de irregularidade menstrual e 45% na presença de oligomenorreia).
Uma dificuldade adicional na adolescente é a presença de ovários multicísticos, definido por Adams e cols. pela presença de ovários de tamanho normal ou aumentado com 6 a 10 cistos com 4 a 10 mm de diâmetro, sem aumento do volume do estroma (41). Esse aspecto morfológico, que pode ser considerado como uma variante do ovário normal, não deve ser confundido com o ovário policístico, o que não é infrequente nessa faixa etária, em decorrência da diminuição da resolução do ultrassom quando realizado pela via transabdominal.
Outras anormalidades
Apesar de a obesidade e de anormalidades da concentração de LH e de a relação entre o LH e o hormônio folículo-estimulante (FSH) serem encontradas com frequência em pacientes com a SOP (2), nenhum dos documentos as considerou como parte da definição da síndrome. De acordo com o Consenso de Rotterdam (8,9), a dosagem de LH pode ser considerada um parâmetro secundário, principalmente para o diagnóstico diferencial de amenorreia.
Exclusão de outras causas
A SOP, como síndrome, é um diagnóstico de exclusão, devendo-se pesquisar doenças que possam mimetizar seu fenótipo. Entretanto, a análise da tabela 2 demonstra que há divergências sobre quais doenças devem ser excluídas e como fazê-lo. Considerando que a forma não clássica de hiperplasia adrenal congênita, disfunções tireoidianas, neoplasias virilizantes da adrenal e do ovário, síndromes de resistência severa à insulina e hiperprolactinemia podem responder por 5% a 10% das síndromes de excesso androgênico (8,9), é sugerido o rastreamento dessas doenças mediante avaliação clínica e/ou laboratorial. Com relação à hiperprolactinemia, embora estudos iniciais apontassem uma prevalência elevada nas pacientes com o fenótipo da síndrome, recentemente demonstrou-se que essa é uma situação infrequente, sendo a maior parte dos casos decorrente de macroprolactinemia ou do efeito do estresse (46).
Alteração da concentração de 17hidroxi-progesterona (17OHP) é encontrada com frequência em pacientes portadoras da SOP (47,48). Esse esteroide é um marcador da presença da forma não clássica de hiperplasia adrenal congênita por deficiência da 21-hidroxilase (FNC-21HAC), uma disfunção adrenal que pode apresentar um fenótipo semelhante ao da SOP (49). O diagnóstico diferencial entre essas duas entidades pode ser feito tanto com a concentração basal de 17OHP quanto após estímulo com ACTH sintético (250 mg por via endovenosa, em bolus, com coleta de sangue 60 minutos após) (2).
Na tabela 2, observa-se que o critério mais frequentemente adotado para o diagnóstico da FNC-21HAC é o de Azziz e cols. (50), que considera que uma concentração basal de 4,0 ng/mL tem a máxima especificidade e valor preditivo positivo para a presença da FNC-21HAC, se coletada no período da manhã e na fase folicular do ciclo menstrual. Para amostras coletadas fora dessas condições, um limite de corte menor deve ser considerado (2,0 ou 3,0 ng/mL). Esse mesmo grupo demonstrou que uma concentração basal < 2,0 ng/mL tem um valor preditivo negativo próximo a 100% (51). Entretanto, caso se adote a 17OHP basal como critério diagnóstico, deve-se levar em consideração a população estudada. De fato, Escobar-Morreale e cols. demonstraram que, para a população espanhola, o limite de corte é de 1,7 ng/mL (52). Com relação à concentração após estímulo, somente a American Society for Reproductive Medicine sugere um limite de corte (> 10 ng/mL) (10). Esse valor tem origem em um normograma publicado por New e cols. (53), no qual o diagnóstico das pacientes com FNC-21HAC se baseou na tipagem do sistema HLA. Com o advento da biologia molecular, novos valores de corte têm sido propostos, sendo que em nosso meio Bachega e cols. observaram que a menor concentração de 17OHP após estímulo obtido em pacientes com FNC-21HAC com genótipo definido foi de 17 ng/mL (54).
Embora disfunções tireoidianas possam se acompanhar de anovulação crônica, o Consenso de Rotterdam considera que a avaliação rotineira da função tireoidiana em pacientes hiperandrogênicas apresente valor limitado, considerando que a incidência dessas disfunções em pacientes com a síndrome não é maior que em mulheres adultas jovens (8,9). Entretanto, o Position Statement da AE-PCOS Society sugere o rastreamento, citando como referência uma prevalência três vezes maior de tireoidite autoimune nas pacientes com a síndrome, com uma manifestação mais precoce da doença (55).
Embora excluído do diagnóstico diferencial da SOP pelo Consenso do NIH, por apresentar ciclos menstruais regulares e ovulatórios, o hirsutismo idiopático, com o advento do Consenso de Rotterdam (8,9) e o Position Statement da AE-PCOS Society (11,12), deve ser considerado também como uma causa a ser excluída. O conceito de hirsutismo idiopático tem se modificado ao longo do tempo (56). Inicialmente foi caracterizado como hirsutismo de causa desconhecida, após a exclusão de outras causas de síndromes hiperandrogênicas. Um conceito atual e estrito é aquele que caracteriza o hirsutismo idiopático pela presença de hirsutismo associado a ciclos menstruais regulares e ovulatórios, na presença de normoandrogenemia e ovários normais à ultrassonografia, também com exclusão de outras causas de hiperandrogenismo.
Finalmente, nas pacientes cuja apresentação inicial seja a presença de oligo/anovulação, o Consenso de Rotterdam sugere que sejam realizadas as dosagens de FSH e estradiol, com o objetivo de excluir-se o hipogonadismo hipergonadotrófico ou falência ovariana prematura, caracterizados por uma concentração aumentada de FSH e diminuída de estradiol (8,9).
CONSIDERAÇÕES FINAIS
O diagnóstico da SOP, por se tratar de uma síndrome, depende de uma combinação dos seus elementos fundamentais, com exclusão de outras doenças que podem se manifestar com fenótipo semelhante. Basicamente, três Consensos sugerem critérios diagnósticos para a síndrome, a partir de suas características fundamentais, hiperandrogenismo, hiperandrogenemia, disfunção menstrual e ovários policísticos. O primeiro Consenso surgiu em 1990 (3), definindo o que se pode chamar do fenótipo clássico da síndrome, caracterizado pelo distúrbio menstrual e manifestações de excesso androgênico. Posteriormente, em 2003 (Consenso de Rotterdam) (8,9) e 2006 (AE-PCOS Society) (8,9), incorporam também como elemento fundamental da síndrome a morfologia ovariana policística, elemento este que não foi considerado no Consenso do NIH (3). A introdução da morfologia ovariana policística como elemento fundamental da síndrome pelo Consenso de Rotterdam levou em consideração que pacientes que apresentam essa morfologia são mais sensíveis à indução de ovulação que mulheres com ciclos menstruais regulares (57). Um avanço significativo foi o de se posicionar sobre os critérios para a caracterização do ovário policístico ao ultrassom, tendo sido adotada a sugestão de um Consenso Internacional sobre o tema (7), também recomendada pelos documentos que se seguiram ao do Consenso de Rotterdam (13,14,20,22).
Se até a década de 80 do século passado a SOP era considerada uma desordem com consequências reprodutiva e estética, com risco aumentado para carcinoma de endométrio, a partir dessa década várias evidências demonstraram também um risco também aumentado para diabetes tipo 2, dislipidemia, hipertensão arterial e possivelmente doença cardiovascular (58), possivelmente decorrente da presença da resistência à insulina. O objetivo do Consenso da AE-PCOS Society foi justamente o de definir fenótipos possivelmente relacionados com resistência à insulina e consequentes distúrbios metabólicos. Considerando que o tratamento da SOP é inespecífico, a escolha do critério para seu diagnóstico deve levar em consideração o objetivo do tratamento, principalmente com relação à prevenção da doença cardiovascular, motivo de um posicionamento específico da AE-PCOS Society (59).
Uma dificuldade na aplicação dos critérios diagnósticos para a SOP consiste na caracterização do excesso androgênico. O hirsutismo é aceito como um marcador confiável, mas a alopecia androgênica e a acne devem ser aceitos com reserva na ausência de distúrbio menstrual e hiperandrogenemia, principalmente em adolescentes. O mesmo ocorre com a hiperandrogenemia isolada, na ausência de sinais de excesso androgênico, devido a limitações de ordem técnica relacionadas a dosagens de hormônios esteroides. Essas limitações podem ser contornadas pelo emprego da cromatografia líquida de alta pressão, que pelo custo é inviável rotineiramente. Permanece como opção a demonstração de aumento da testosterona livre, seja por meio da aplicação da fórmula de Vermeulen ou do cálculo do índice de testosterona livre.
Finalmente, a dificuldade está com relação ao diagnóstico da SOP em adolescentes, período no qual algumas das características fundamentais da síndrome podem estar presentes ou serem um achado transitório. Assim, é prudente que esse diagnóstico seja feito somente em adolescentes com a máxima probabilidade de apresentar a síndrome. De acordo com uma proposta de Carmina e cols. (60), seria necessária a presença dos três critérios do Consenso de Rotterdam (8,9). Adicionalmente, somente o hirsutismo seria aceito como sinal de excesso androgênico e o distúrbio menstrual (oligomenorreia) valorizado se presente por pelo menos dois anos.
APÊNDICE
O cálculo da testosterona livre, realizado por meio da fórmula de Vermeulen, pode ser obtido no endereço eletrônico: http://www.issam.ch/freetesto.htm.
O cálculo do índice de testosterona livre é realizado pela seguinte fórmula, assumindo-se que a concentração de albumina seja normal: Testosterona total (nM/L)/SHBG (nM/L) X 100.
Declaração: os autores declaram não haver conflitos de interesse científico neste estudo
Recebido em 20/Out/2010
Aceito em 28/Jan/2011
- 1. Stein IF, Leventhal ML. Amenorrhea associated with bilateral polycystic ovaries. Am J Obstet Gynecol. 1935;29:181-91.
- 2. Marcondes JAMM, Hayashida SAY, Bachega TASS. Hirsutismo e síndrome dos ovários policísticos. In: Saad MJA, Maciel RMB, Mendonça BB, editors. Endocrinologia. São Paulo: Atheneu; 2007. p. 635-82.
- 3. Zawadeski JK, Dunaif A. Diagnostic criteria for PCOS: towards a more rational approach. In: Dunaif A, Givens JR, Haseltine FP, Merriam MR, editors. PCOS. Boston: Blackwell Scientific; 1992. p. 377-84.
- 4. Goodman NF, Bledsoe MB, Cobin RH, Futterweit W, Goldzieher JW, Petak SM, et al. American Association of Clinical Endocrinologists medical guidelines for the clinical practice for the diagnosis and treatment of hyperandrogenic disorders. Endocr Pract. 2001;14:120-34.
- 5. American College of Obstetricians and Gynecologists. ACOG practice bulletin. Polycycstic ovary syndrome. Int J Gynaecol Obstet. 2003;80:335-48.
- 6. Schroeder BM. American College of Obstetricians and Gynecologists. ACOG releases guidelines on diagnosis and management of polycystic ovary syndrome. Am Fam Physician. 2003;67:1619-20.
- 7. Balen AH, Laven JS, Tan SL, Dewailly D. Ultrasound assessment of the polycystic ovary: International consensus definitions. Hum Reprod Update. 2003;9:505-14.
-
8Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod. 2004;19:41-7.
- 9. Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril. 2004;81:19-25.
- 10. Practice Committee of the American Society for Reproductive Medicine. The evaluation and treatment of androgen excess. Fertil Steril. 2006;86:S241-7.
- 11. Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W, et al. Androgen Excess Society. Positions statement: criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: an Androgen Excess Society guideline. J Clin Endocrinol Metab. 2006;91:4237-45.
- 12. Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W, et al. Task Force on the Phenotype of the Polycystic Ovary Syndrome of The Androgen Excess and PCOS Society. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: the complete task force report. Fertil Steril. 2009;91:456-88.
- 13. Martin KA, Chang RJ, Ehrmann DA, Ibanez L, Lobo RA, Rosenfield RL, et al. Evaluation and treatment of hirsutism in premenopausal women: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2008;93:1105-20.
- 14. ACOG Committee on Practice BulletinsGynecology. ACOG Practice Bulletin no. 108: Polycystic ovary syndrome. Obstet Gynecol. 2009;114:936-49.
- 15. Blume-Peytavi U, Atkin S, Shapiro J, Lavery S, Grimalt R, Hoffmann R, et al. Skin Academy. European Consensus on the evaluation of women presenting with excessive hair growth. Eur J Dermatol. 2009;19:597-602.
- 16. Azziz R, Woods KS, Reyna R, Key TJ, Knochenhauer ES, Yildiz BO. The prevalence and features of the polycystic ovary syndrome in an unselected population. J Clin Endocrinol Metab. 2004;89:2745-9.
- 17. Azziz R, Sanchez LA, Knochenhauer ES, Moran C, Lazenby J, Stephens KC, et al. Androgen excess in women: experience with over 1000 consecutive patients. J Clin Endocrinol Metab. 2004;89:453-62.
- 18. Cunliffe WJ, Gould DJ. Prevalence of facial acne vulgaris in late adolescence and in adults. Br Med J. 1979;1:1109-10.
- 19. Dalgard F, Svensson A, Holm JO, Sundby J. Self-reported skin morbidity in Oslo. Associations with sociodemographic factors among adults in a cross-sectional study. Br J Dermatol. 2004;151:452-7.
- 20. Galobardes B, Davey Smith G, Jefferys M, McCarron P. Has acne increased? Prevalence of acne history among university students between 1948 and 1968. The Glasgow Alumni Cohort Study. Br J Dermatol. 2005;152:824-5.
- 21. Stathakis V, Kilkenny M, Marks D. Descriptive epidemiology of acne vulgaris in the community. Australas J Dermatol. 1997;8:115-23.
- 22. Collier CN, Harper JC, Cantrell WC, Wang W, Foster KW, Elewski BE. The prevalence of acne in adults 20 years and older. J Am Acad Dermatol. 2008;58:56-9.
- 23. Futterweit W, Dunaif A, Yeh C, Kingsley P. The prevalence of hyperandrogenism in 109 consecutive female patients with diffuse alopecia. J Med Acad Dermatol. 1988;19:831-6.
- 24. Ferriman DM, Gallwey JD. Clinical assessment of body hair growth in women. J Clin Endocrinol. 1961;21:1440-7.
- 25. Hatch R, Rosenfield RL, Kim MH, Tredway D. Hirsutism: implications, etiology, and management. Am J Obstet Gynecol. 1981;140:815-30.
- 26. Barth JH. How robust is the methodology for trials of therapy in hirsute women? Clin Endocrinol. 1996;45:379-80.
- 27. Wild RA, Vesely S, Beebe L, Whitsett T, Owen W. Ferriman Gallwey self-scoring I: performance assessment in women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2005;90:4112-4.
- 28. Ewing JA, Rouse BA. Hirsutism, race and testosterone levels: comparison of East Asians and Euroamericans. Hum Biol. 1978;50:209-15.
- 29. Ferriman D, Purdie AW. The aetiology of oligomenorrhoea and/or hirsuties: a study of 467 patients. Postgrad Med J. 1983;59:17-20.
- 30. DeUgarte CM, Woods KS, Bartolucci AA, Azziz R. Degree of facial and body terminal hair growth in unselected black and white women: toward a populational definition of hirsutism. J Clin Endocrinol Metab. 2006;91:1345-50.
- 31. Souter I, Sanchez A, Perez M, Bartolucci AA, Azziz R. The prevalence of androgen excess among patients with minimal unwanted hair growth. Am J Obstet Gynecol. 2004;191:1914-20.
- 32. Chang WY, Knochenhauer ES, Bartolucci AA, Azziz R. Phenotypic spectrum of polycystic ovary syndrome: clinical and biochemical characterization of the three major clinical subgroups. Fertil Steril. 2005;83:1717-23.
- 33. Kumar A, Woods KS, Bartolucci AA, Azziz R. Prevalence of adrenal androgen excess in patients with the polycystic ovary syndrome (PCOS). Clin Endocrinol. 2005;62:644-9.
- 34. Knochenhauer ES, Key TJ, Kahsar-Miller M, Waggoner W, Boots LR, Azziz R. Prevalence of the polycystic ovary syndrome in unselected black and white women of the southeastern United States: a prospective study. J Clin Endocrinol Metab. 1998;83:3078-82.
- 35. Rosner W, Auchus RJ, Azziz R, Sluss PM, Raff H. Position statement: utility, limitations, and pitfalls in measuring testosterone: an Endocrine Society position statement. J Clin Endocrinol Metab. 2007;92:405-13.
- 36. Vermeulen A, Verdonck L, Kaufman JM. A critical evaluation of simple methods for the estimation of free testosterone in serum. J Clin Endocrinol Metab. 1999;84:3666-72.
- 37. Wiltgen D, Spritzer PM. Variation in metabolic and cardiovascular risk in women with different polycystic ovary syndrome phenotypes. Fertil Steril. 2010;94(6):2493-6. Epub 2010 Mar 24.
- 38. Guastella E, Longo RA, Carmina E. Clinical and endocrine characteristics of the main polycystic ovary syndrome phenotypes. Fertil Steril. 2010;94(6):2197-201. Epub 2010 Mar 19.
- 39. Van Hooff MH, Voorhorst FJ, Kaptein MB, Hirasing RA, Koppenaal C, Schoemaker J. Predictive value of menstrual cycle pattern, body mass index, hormone levels and polycystic ovaries at age 15 years for oligo-amenorrhoea at age 18 years. Hum Reprod. 2004;19:383-92.
- 40. Swanson M, Sauerbrei EE, Cooperberg PL. Medical implications of ultrasonically detected polycystic ovaries. J Clin Ultrasound. 1981;9:219-22.
- 41. Adams J, Polson DW, Abdulwahid N, Morris DV, Franks S, Mason HD, et al. Multifollicular ovaries: clinical and endocrine features and response to pulsatile gonadotropin releasing hormone. Lancet. 1985;2:1375-9.
- 42. Goldstein G. Incorporating endovaginal ultrasonography into the overall gynaecologic examination. Am J Obstet Gynecol. 1990;160:625-2.
- 43. Pache TD, de Jong FH, Hop WC, Fauser BC. Association between ovarian changes assessed by transvaginal sonography and clinical and endocrine signs of the polycystic ovary syndrome. Fertil Steril. 1993;59:544-9.
- 44. Crowley WF Jr, Hall JE, Martin KA, Adams J, Taylor AE. An overview of the diagnostic considerations in polycystic ovarian syndrome. Ann N Y Acad Sci. 1993;687:235-41.
- 45. Murphy MK, Hall JE, Adams JM, Lee H, Welt CK. Polycystic ovarian morphology in normal women does not predict the development of polycystic ovary syndrome. J Clin Endocrinol Metab. 2006;91:3878-84.
- 46. Escobar-Morreale HF. Macroprolactinemia in women presenting with hyperandrogenic symptoms: implications for the management of polycystic ovary syndrome. Fertil Steril. 2004;82:1697-9.
- 47. Pinheiro SA, Clapauch R. Importância da dosagem da 17OH-progesterona na síndrome dos ovários policísticos. Arq Bras Endocrinol Metab. 2001;45:361-8.
- 48. Chetkowski RJ, Chang RJ, DeFazio J, Meldrum DR, Judd HL. Origin of serum progestins in polycystic ovarian disease. Obstet Gynecol. 1984;64:27-31.
- 49. Marcondes JAM, Minanni SL, Sakamoto LC, Hayashida SY, Halbe HW, Wajchenberg BL. O espectro clínico e laboratorial da forma não clássica de hiperplasia adrenal congênita por deficiência da 21-hidroxilase. Arq Bras Endocrinol Metab. 1995;39:37-43.
- 50. Azziz R, Hincapie LA, Knochenhauer ES, Dewailly D, Fox L, Boots LR. Sceening for 21-hydroxylaser-deficient nonclassic adrenal hyperplasia among hyperandrogenic women: a prospective study. Fertil Steril. 1999;72:915-25.
- 51. Azziz R, Zacur HA. 21-hydroxylase deficiency in female hyperandrogenism: screening and diagnosis. J Clin Endocrinol Metab. 1989;69:577-84.
- 52. Escobar-Morreale HF, Sanchón R, San Millán JL. A prospective study of the prevalence of nonclassical congenital adrenal hyperplasia among women presenting with hyperandrogenic symptoms and signs. J Clin Endocrinol Metab. 2008;93:527-33.
- 53. New MI, Lorenzen F, Lerner AJ, Kohn B, Oberfield SE, Pollack MS, et al. Genotyping steroid 21-hydroxylase deficiency: hormonal reference data. J Clin Endocrinol Metab. 1983;57:320-6.
- 54. Bachega TA, Billerbeck AE, Marcondes JA, Madureira G, Arnhold IJ, Mendonca BB. Influence of different genotypes on 17-hydroxyprogesterone levels in patients with nonclassical congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Clin Endocrinol. 2000;52:601-7.
- 55. Janssen OE, Mehlmauer N, Hahn S, Offner AH, Gartner R. High prevalence of autoimmune thyroiditis in patients with polycystic ovary syndrome. Eur J Endocrinol. 2004;150:363-9.
- 56. Azziz R, Carmina E, Sawaya ME. Idiopathic hirsutism. Endocr Rev. 2000;21:347-62.
- 57. Van Der Meer M, Hompes PG, De Boer JA, Schats R, Schoemaker J. Cohort size rather than follicle-stimulating hormone threshold level determines ovarian sensitivity in polycystic ovary syndrome. J Clin Endocrinol Metab. 1998;83:423-6.
- 58. Azziz R, Marin C, Hoq L, Badamgarav E, Song P. Health care-related economic burden of the polycystic ovary syndrome during the reproductive life span. J Clin Endocrinol Metab. 2005;90:4650-8.
- 59. Wild RA, Carmina E, Diamanti-Kandarakis E, Dokras A, Escobar-Morreale HF, Futterweit W, et al. Assessment of cardiovascular risk and prevention of cardiovascular disease in women with the polycystic ovary syndrome: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome (AE-PCOS) Society. J Clin Endocrinol Metab. 2010;95:2038-49.
- 60. Carmina E, Oberfield SE, Lobo RA. The diagnosis of polycystic ovary syndrome in adolescents. Am J Obstet Gynecol. 2010;203:201-6.
Datas de Publicação
-
Publicação nesta coleção
24 Mar 2011 -
Data do Fascículo
Fev 2011
Histórico
-
Recebido
20 Out 2010 -
Aceito
28 Jan 2011